Page 14 - Pigmenti
P. 14
TEORIA CHIMICA DEL COLORE
Il chimico analitico, invece, deve concentrarsi soprattutto sulla luce assorbita per poter individuare
correttamente le sostanze responsabili della colorazione evidente a livello macroscopico.
Talvolta le sostanze responsabili del colore possono essere delle semplici impurezze presenti nel
reticolo cristallino di un composto a livello di un atomo ogni 100.000.
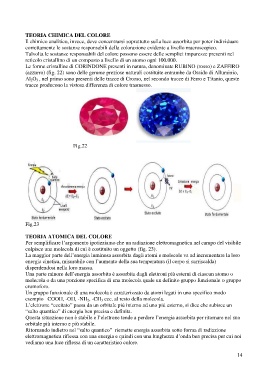
Le forme cristalline di CORINDONE presenti in natura, denominate RUBINO (rosso) e ZAFFIRO
(azzurro) (fig. 22) sono delle gemme preziose naturali costituite entrambe da Ossido di Alluminio,
Al 2O 3 , nel primo sono presenti delle tracce di Cromo, nel secondo tracce di Ferro e Titanio, queste
tracce producono la vistosa differenza di colore trasmesso.
Fig.22
Fig.23
TEORIA ATOMICA DEL COLORE
Per semplificare l’argomento ipotizziamo che un radiazione elettromagnetica nel campo del visibile
colpisce una molecola di cui è costituito un oggetto (fig. 23).
La maggior parte dell’energia luminosa assorbita dagli atomi e molecole va ad incrementare la loro
energia cinetica, misurabile con l’aumento della sua temperatura (il corpo si surriscalda)
disperdendosi nella loro massa.
Una parte minore dell’energia assorbita è assorbita dagli elettroni più esterni di ciascun atomo o
molecola o da una porzione specifica di una molecola quale un definito gruppo funzionale o gruppo
cromoforo.
Un gruppo funzionale di una molecola è caratterizzato da atomi legati in uno specifico modo
esempio –COOH, -OH, -NH 2, -CH 3 ecc. al resto della molecola.
L’elettrone “eccitato” passa da un orbitale più interno ad uno più esterno, si dice che subisce un
“salto quantico” di energia ben precisa e definita.
Questa situazione non è stabile e l’elettrone tende a perdere l’energia assorbita per ritornare nel suo
orbitale più interno e più stabile.
Ritornando indietro nel “salto quantico” riemette energia assorbita sotto forma di radiazione
elettromagnetica riflessa con una energia e quindi con una lunghezza d’onda ben precisa per cui noi
vediamo una luce riflessa di un caratteristico colore.
14