Page 144 - Pigmenti
P. 144
Metalli
Nome: ORO Sinonimi: /
Formula chimica Colore Origine Utilizzo storico Tecniche di Potere Potere
utilizzo colorante coprente
Au GIALLO NATURALE Si trova in Si utilizza in alto potere Alto
METALLIZZ allo stato natura in foglia o colorante potere
ORO ATO elementare pepite o polvere per coprente
(nativo) pagliuzze, si pitture a
prepara la Tempera e
foglia per olio.
laminazione,
utilizzato fin
dal
Medioevo.
Stabilità chimica Stabilità Compatibilità Tossicità Costo 100 g
fotochimica chimica
E’ stabile, Stabile alla Compatibile Non 3000 Euro
inalterabile luce e calore. con tutti i tossico
dagli agenti pigmenti.
atmosferici .
E’ insolubile
in acidi e basi.
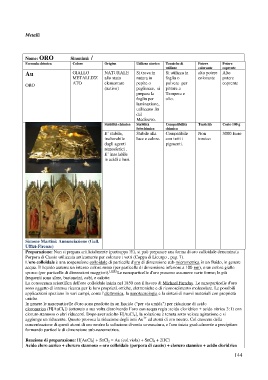
Simone Martini: Annunciazione (Gall.
Uffizi-Firenze)
Preparazione: Non si prepara artificialmente (purtroppo !!!), si può preparare una forma di oro colloidale denominata
Porpora di Cassio utilizzata anticamente per colorare i vetri (Coppa di Licurgo , pag. 7).
L'oro colloidale è una sospensione colloidale di particelle d'oro di dimensione sub-micrometrica in un fluido, in genere
acqua. Il liquido assume un intenso colore rosso (per particelle di dimensione inferiore a 100 nm), o un colore giallo
sporco (per particelle di dimensioni maggiori). [1][2] Le nanoparticelle d'oro possono assumere varie forme; le più
frequenti sono sfere, bastoncini, cubi, e calotte.
La conoscenza scientifica dell'oro colloidale inizia nel 1850 con il lavoro di Michael Faraday. Le nanoparticelle d'oro
sono oggetto di intensa ricerca per le loro proprietà ottiche, elettroniche e di riconoscimento molecolare. Le possibili
applicazioni spaziano in vari campi, come l'elettronica, la nanotecnologia e la sintesi di nuovi materiali con proprietà
uniche
In genere le nanoparticelle d'oro sono prodotte in un liquido ("per via umida") per riduzione di acido
cloroaurico (H[AuCl 4 ]) (ottenuto a sua volta dissolvendo l’oro con acqua regia :acido cloridrico + acido nitrico 3:1) con
cloruro stannoso o altri riducenti. Dopo aver sciolto H[AuCl 4 ], la soluzione è tenuta sotto veloce agitazione e si
3+
aggiunge un riducente. Questo provoca la riduzione degli ioni Au ad atomi di oro neutro. Col crescere della
concentrazione di questi atomi di oro neutro la soluzione diventa sovrasatura, e l'oro inizia gradualmente a precipitare
formando particelle di dimensione sub-nanometrica.
Reazione di preparazione: H[AuCl 4 ] + SnCl 2 = Au (col.viola) + SnCl 4 + 2HCl
Acido cloro aurico + cloruro stannoso = oro colloidale (porpora di cassio) + cloruro stannico + acido cloridrico
144